Generalidades
La automatización arribó a la industria farmacéutica para expandirse en todas sus áreas. En este sentido, los laboratorios químicos (especialmente los que requieren un elevado nivel de eficiencia, como el de Control de Calidad) no son la excepción a este avance. Es por ello que se encuentran funcionando cientos de “robots analíticos” a lo largo del mundo para optimizar el procesamiento de muestras en diferentes tipos de ensayos.
Los sistemas automáticos para laboratorios más difundidos han sido desarrollados principalmente con el objetivo de aliviar la carga manual, reducir el consumo de
solventes, optimizar la reproducibilidad de resultados y asegurar la integridad de datos en ensayos de rutina para productos farmacéuticos, como el Test de disolución y el de Uniformidad de Contenido que demandan elevadas horas/hombre.
Los sistemas diseñados para preparación de muestras, se aplican principalmente para procesar grandes volúmenes de formas sólidas (comprimidos, cápsulas o polvos). Algunos sistemas (ver Figura 1) permiten procesar hasta 200 muestras de manera totalmente autónoma, con posibilidad de colectarlas y luego trasladarlas a equipos analíticos (cromatógrafo, espectrómetro UV-visible, titulador, etc.) o programarlos para que el análisis se ejecute directamente en línea.

Automatización Equipo Sotax TPW
Estas aplicaciones se relacionan comúnmente a ensayos de valoración, uniformidad de contenido y análisis de impurezas, aplicables tanto a control de calidad como a validaciones de proceso. Otros están diseñados para preparaciones más sencillas y usando menor cantidad de muestras (no más de 30), con la posibilidad de realizar titulaciones volumétricas o trasladar las muestras a otra unidad analítica.
El otro nicho que explota la robotización de laboratorios farmacéuticos ocupa los laboriosos ensayos de disolución de formas sólidas, donde se evita la intervención manual en las etapas de preparación y dosificación de medios (incluyendo intercambios dentro del mismo ensayo), dispensación y recolección de muestras, lavado de vasos, intercambio de cestillas y retiro de sinkers. Aquí también es posible
la recolección de muestras o el análisis en línea de más de 20 lotes de producto (asumiendo 6 unidades por lote), dependiendo de la configuración del equipo. Hay equipos que -dependiendo de los modelos- permiten procesar hasta 8 lotes con 3 medios diferentes o hasta más de 20 lotes con 8 medios diferentes, dependiendo del tamaño de las unidades de dosificación. Ver Figura 2 y Figura 3.

La implementación de estas tecnologías permite optimizar los tiempos que los analistas dedican a tareas manuales repetitivas, monótonas, fatigantes, sujetas a error humano y con limitaciones horarias. Por el contrario, estos equipos operan reproduciblemente, minimizando el consumo de solventes, de manera ininterrumpida durante varios días, monitoreando todas las variables de proceso y colectando
los datos necesarios de manera segura.
De esta forma, el personal técnico cuenta con mayor disponibilidad horaria para dedicarse tanto a las tareas manuales más complejas como a la interpretación de variables analíticas.
Situación global
La mayoría de las compañías farmacéuticas líderes a nivel mundial han optado por automatizar parte de sus análisis de laboratorio, especialmente para productos con prolongadas campañas de elaboración. En Sudamérica, de manera más tardía pero no menos exitosa, se ha comenzado a implementar este tipo tecnología en países como Argentina, Brasil y Uruguay. En cambio, en Norteamérica y Europa, laboratorios pertenecientes a plantas poco diversificadas o mono-producto ya realizan sus análisis de Control de Calidad con mínima intervención humana.
Regionalmente, dada la necesidad de gestionar instalaciones multi-producto, los desafíos son aún mayores porque deben implementarse corridas donde suele ser necesario intercalar diferentes métodos en forma secuencial. Para estos casos, los diseños de lavado deben ser detalladamente evaluados (ensayos de carry over) frente a matrices complejas de formulaciones y solventes, de forma de evitar incompatibilidades en el cambio de proceso metodológico.
Si bien existen pocos lineamientos específicos, emitidos por organismos reconocidos internacionalmente, que se orienten a este tipo de automatización, se aplican criterios generales de validación de técnicas y transferencias analíticas, sumando el “know how” compartido por usuarios expertos en los seminarios de automatización organizados por los proveedores de equipamiento.
Ejemplos comparativos de ensayos manuales vs automáticos
A continuación, se detallan los resultados obtenidos en dos transferencias de metodologías manuales a automáticas, para los ensayos de uniformidad de contenido y disolución, realizados en equipos automáticos (5). Vale aclarar
que los mismos pertenecen a una serie de lotes, definidos por el protocolo de transferencia, que a fines prácticos no se incluyen en el presente artículo.
A. Preparación de muestras para análisis de Uniformidad de Contenido, en comprimidos de rosuvastatina, empleando una Estación de Procesamiento de Comprimidos (6).
B. Test de Disolución, en comprimidos de tioctamida, empleando
el sistema automático de mesada (7)
Tabla A: Cálculo de diferencia de medias (muestras no apareadas), aplicado a un lote de rosuvastatina 20 mg en comprimidos, perteneciente a una corrida de transferencia analítica.
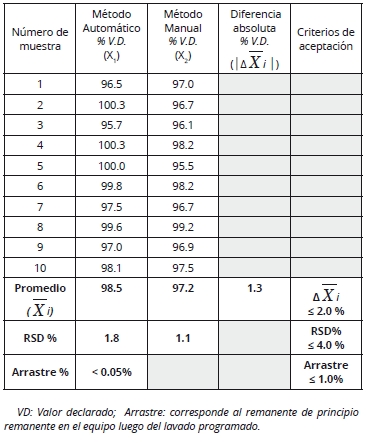
Tabla B: Cálculo de diferencia de medias (muestras apareadas), aplicado a un lote de tioctamida 50 mg en comprimidos, perteneciente a una corrida de transferencia analítica.

Automatización e integridad de datos
Los sistemas automáticos de primera línea también contemplan la cobertura de integridad de datos y validación en todo lo referente a CFR 21.11, FDA “Data Integrity and Compliance with cGMP Guidance for Industry, WHO “Guidance
on Good Data Management”, MHRA “Data Integrity Definitions and Guidance” y “Good Manufacturing Practices (GAMP 5) de ISPE.
Es por todos conocido que, en los últimos años, las autoridades regulatorias (en especial FDA) vienen observando un incremento en el incumplimiento de normas cGMP relacionadas a este aspecto. Esto representa un problema para las compañías farmacéuticas que necesitan suministrar sus productos en mercados de elevado nivel de vigilancia regulatoria, dado que deben adecuar sus sistemas de
gestión de calidad a estas exigencias.
Los equipos para automatizar actividades de laboratorio cuentan con softwares que garantizan la confiabilidad de la información en un entorno validado. Los mismos sostienen tal cumplimiento bajo el principio de ALCOA:
- Atribuible: permiten determinar quién y cuándo se generó el dato.
- Legible: los datos quedan registrados de manera leíble en diferentes idiomas configurables.
- Contemporáneo: los registros se van almacenando mientras se generan.
- Original: no existe transcripción de datos.
- Acertado: la información es correctamente medida (exacta).
Tanto la FDA, como otras agencias regulatorias de similar nivel de exigencia, viene utilizando este acrónimo como guía en sus inspecciones con la expectativa de encontrar cumplimiento en sistemas basados en papel, informatizados
o híbridos.
Otro tópico cubierto por este tipo de tecnología es el “Audit Trail”, que también es requerido independientemente del sistema de documentación empleado. Si bien la gestión en papel e híbrida se encuentran permitidas, son extremadamente engorrosas de llevar adelante en laboratorios de alta productividad. En estos casos, conociendo las dificultades para mantener dichos sistemas, las agencias suelen solicitar un plan de upgrade en plazos razonables. La robotización permite el cumplimiento para audit trails, asegurando:
- Identificación de usuarios con diferentes niveles de permiso y privilegios.
- Fecha y hora de registros (vital para establecer veracidad y confiabilidad de los registros electrónicos).
- Conexión a registros que aseguren trazabilidad.
- Valores originales y sus modificaciones para contar con un historial completo y poder reconstruir una secuencia de eventos.
- Explicación de cambios, donde sobre un dato inicial se debe indicar el motivo, quedando registrado ID responsable, fecha y hora del evento.
La revisión periódica de los audit trail es normalmente configurable de manera de facilitar su también exigida ejecución.
Desafíos
La automatización se encuentra afianzada en la gran mayoría de las industrias con elevado valor agregado de sus productos. Entre ellas, la industria farmacéutica tiene pendiente un importante camino por recorrer, especialmente en los países de nuestra región y, aún más, en los laboratorios de análisis. Considerando que su empleo requiere normalmente de posibles desarrollos analíticos, ajustes y transferencias, resulta importante tener en cuenta, durante los proyectos de aplicación, el entrenamiento técnico, lead times de implementación, costos de adecuación de metodologías a nivel productivo y concientización del personal sobre este cambio de paradigma para el laboratorio químico farmacéutico. ♦
Referencias
— Tablet Processing Workstation User´s Manual, Sotax P/N 121323, Rev.3
— AT MD Hardware User´s Manual, Sotax version 05 / 2017-06-14
— 11th Annual Automation Seminar, Boston USA 2017, by global automation users.
— Data Integrity Training Course for Chemist College, Puerto Rico 2017 by Geoffrey Grove
Ph.D.
— FDA “Data Integrity and Compliance with cGMP Guidance for Industry, April 2016.
Gabriel Cattólica: Bioquímico egresado de la Universidad de Buenos Aires. Jefe de Control de Calidad durante 15 años en laboratorios Gador, gestionando proyectos de modernización y automatización de laboratorios. Recientemente ha sido nombrado Gerente de Unidad de Calidad en Abbott, div. LIA. Auditor líder certificado por el International Register of Certified Auditors (IRCA) de Alemania, sobre Sistemas de Gestión de Calidad (2013). Miembro activo de la International Society of Pharmaceutical Engineering (ISPE) desde 2007. Disertante en el 11th Annual Automation Seminar sobre “Small Volume Automated Sample Preparation” en Boston – USA, 2017.
Milton Cordone: Químico Asesor para Industria Farmacéutica, Alimenticia y afines con especialización en desarrollo de aplicaciones para equipos automatizados de laboratorio. Analista Sr de Control de Calidad durante 7 años en laboratorios Gador. Disertante sobre “Estadística Aplicada a la Industria Farmacéutica”, Facultad de Farmacia y Bioquímica – UBA. Junio 2014 y Agosto 2015. Disertante en Seminarios de “Automatización de Laboratorios Farmacéuticos” para: Lobov Argentina: Buenos Aires (Mayo 2015) Disotax Brasil: Goias (Septiembre 2016) – Río de Janeiro (Octubre 2016) – San Pablo (Diciembre 2015 y Noviembre 2016).
Por Gabriel Cattólica y Milton Cordone
Fuente: Revista SAFYBI EDICION N°155 – Septiembre 2017

 Argentina
Argentina  Paraguay
Paraguay



