1. ¿Qué son las endotoxinas bacterianas?
Las endotoxinas bacterianas se encuentran en la membrana externa de la pared celular de las bacterias gramnegativas. El efecto endotóxico de las bacterias gramnegativas se debe principalmente al lípido A, un componente de los lipopolisacáridos (LPS) que puede inducir respuestas pirógenas (que producen fiebre) potencialmente peligrosas e incluso fatales si se encuentran en el torrente sanguíneo y otros fluidos corporales en concentraciones superiores a ciertos niveles. Como algunos productos farmacéuticos y dispositivos médicos ingresan en el torrente sanguíneo, en esas industrias son obligatorias las pruebas de detección de endotoxinas. Por su fuerte toxicidad y su efecto en la seguridad de los pacientes, las endotoxinas son reguladas en todo el mundo por la FDA de EE.UU. y la farmacopea internacional en el caso de cualquier producto de las biociencias que vaya a estar en contacto con sangre humana y/o animal.
2. ¿Por qué hay que hacer pruebas de detección de endotoxinas bacterianas?
En el sector farmacéutico y el de los equipos médicos, así como otras industrias de las ciencias biológicas, las pruebas de detección de endotoxinas son cruciales para el control de calidad y la seguridad del paciente. Las pruebas de detección de endotoxinas se realizan en sistemas de agua de uso farmacéutico, entre ellos el agua para inyección (WFI) usada como ingrediente, y productos terminados como fármacos, fármacos veterinarios y productos biológicos y para dispositivos médicos. Los productos médicos y farmacéuticos testeados incluyen los productos farmacéuticos para uso parenteral (administrados a través de inyección por vía intravenosa, subcutánea, intramuscular e intradérmica) y los dispositivos médicos que tienen contacto directo o indirecto con la sangre, el sistema cardiovascular, el sistema linfático o el líquido cefalorraquídeo. Las farmacopeas internacionales (USP , EP 2.6.14 y JP 4.01) describen las normas para el testeo de endotoxinas bacterianas (BET, según su sigla en inglés) y los límites de endotoxinas. Las directrices de la FDA incluyen recomendaciones para fabricantes de productos biológicos, fármacos y equipos médicos basadas en los conceptos vigentes sobre las recomendaciones para los testeos y los criterios de aceptación cubiertos en los procedimientos farmacopeicos.
3. ¿Cómo se realizan las pruebas de detección de endotoxinas?
Durante casi 40 años, la FDA de EE. UU. ha aceptado la prueba mediante lisado de amebocitos de Limulus (LAL) para la detección de endotoxinas en productos terminados. Este ensayo in vitro, que se usa en lugar de la prueba de pirógenos en conejos, permite detectar la presencia y la concentración de endotoxinas bacterianas. En las pruebas de LAL, el lisado de la sangre de cangrejos herradura (Limulus polyphemus) reacciona con las endotoxinas bacterianas y así confirma su presencia en una muestra. Existen tres métodos principales para los testeos con LAL: turbidimétrico, cromogénico y de gelificación. En el método de gelificación, se mezclan el LAL y la muestra, y el operador busca detectar la formación de gel o coágulos en el tubo de reacción. Los resultados se obtienen a partir de la interpretación subjetiva de la formación del coágulo, por lo cual el método de gelificación es una prueba cualitativa. En los métodos turbidimétrico y cromogénico, las muestras se mezclan con el reactivo LAL y se van midiendo el cambio de color y la turbidez en diferentes momentos. Los métodos cromogénico y turbidimétrico para los ensayos LAL son cuantitativos y muestran la cantidad de endotoxinas presente. Los resultados se calculan tomando como referencia una curva de calibración. Los límites de endotoxinas y las normas para realizar los BET se describen en la farmacopea internacional, USP , EP 2.6.14 y JP 4.01. Un capítulo general nuevo de la Farmacopea Europea describe un método para BET en el que se usa el factor C recombinante (rFC) en vez del clásico método basado en LAL.
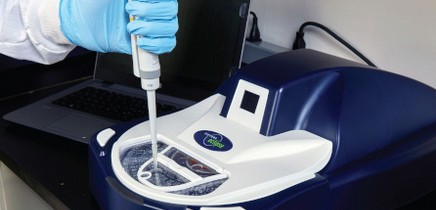
4. ¿Qué cantidad de reactivo de lisado de amebocitos de Limulus (LAL) se usa con la plataforma para BET Sievers Eclipse?
Con apenas 1 mL del reactivo de LAL, en la plataforma Eclipse se pueden procesar 21 muestras. Al reducir hasta en un 90% el uso de lisado de cangrejo herradura (HSC, por su sigla en inglés), Eclipse disminuye la demanda de este valioso recurso natural y permite realizar ensayos de endotoxinas bacterianas (BET) que cumplen todas las normas sin perjudicar a la población global de HSC.
5. ¿La plataforma para BET Sievers Eclipse cumple con todas las normas?
Sí. La plataforma Eclipse utiliza LAL disponible en el mercado, con licencia de la FDA, y cumple todos los requisitos de la farmacopea internacional armonizada: USP , EP 2.6.14 y JP 4.01. Las pruebas de detección de endotoxinas con la plataforma Eclipse incluyen: curva de calibración con un mínimo de tres puntos por duplicado, con endotoxina estandarizada; muestras y controles de productos positivos (PPC) por duplicado; controles negativos por duplicado; certificación de lotes de lisados por triplicado a cargo de analistas; uso de LAL con licencia de la FDA. Además, cumple con 21 CFR Parte 11 y las pautas de integridad de datos.
6. Con Sievers Eclipse, ¿las curvas estándar se automatizan?
Sí. Habitualmente, para que las pruebas de endotoxinas cumplan con las normas el usuario final debe armar una curva de calibración de al menos tres puntos por duplicado a partir de un vial base de endotoxina estandarizada; además, deben hacérseles controles negativos por duplicado y se debe procesar cada muestra por duplicado con PPC, también por duplicado. Con la plataforma para BET Sievers Eclipse, estos pasos se automatizan de acuerdo con estándares de endotoxinas precargados, que alcanzan una curva de calibración de hasta cinco puntos, y PPC también configurados previamente. Por lo tanto, lo único que debe hacer el usuario final es cargar el agua para BET y las muestras en la placa, sin necesidad de preparar nada más. Como resultado, se puede preparar el ensayo en solo 9 minutos, mientras que con las otras plataformas generalmente se tarda más de 60.
Productos Relacionados
Plataforma de testeo de endotoxinas bacterianas (BET) Sievers Eclipse
Analizador rápido de carga biológica Sievers Soleil
Notas Técnicas Relacionadas
Validación de limpieza de laboratorio con analizadores de TOC Sievers M9

 Argentina
Argentina  Paraguay
Paraguay